药物临床试验运行流程及研究人员工作指南
来源:泰州市中医院 作者:编辑 时间:2016-07-07 15:06:59
一、药物临床试验运行流程图:
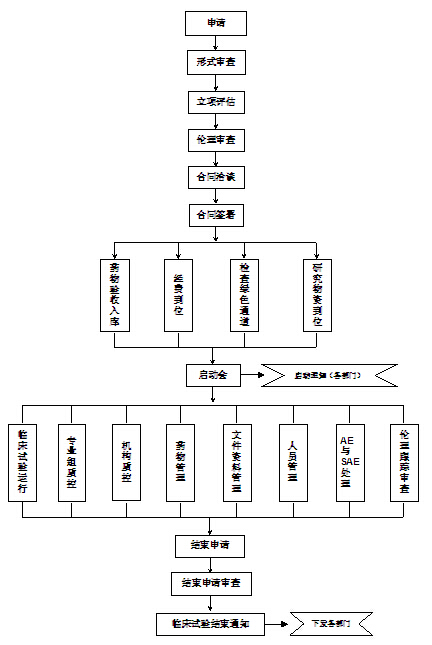
二、研究人员工作指南:
1、伦理审查:项目负责人/主要研究者参照“伦理委员会办事指南”,填写《伦理审查申请表》,准备送审材料,并在伦理审查会议中进行汇报。
2、药物验收入库:机构药库管理员负责临床试验药物的验收,填写《临床试验药物验收入库单》,验收时应认真核对药物信息与装箱清单。
3、启动会:所有参与该临床试验的研究人员均应准时参加启动培训,经主要研究者授权后方能参加临床试验。如未能及时参加启动培训,应接受主要研究者培训(做好培训记录)并经授权后方能参加临床试验。新研究人员的加入应及时通知机构办公室。
4、临床试验运行:(1)研究者应对受试者进行充分的知情同意,签署知情同意书后方进入筛选期。(2)研究人员应严格按照临床试验方案执行。(3)研究人员应及时填写《受试者筛选入选表》、《受试者签认代码表》、《临床试验药物使用记录表》等资料。(4)研究人员应做好原始数据(如门诊病历、住院病历、研究病历)的记录,并保证数据真实、可靠、规范。(5)研究者应配合机构质控员与监查员进行项目质控,并针对提出的问题进行整改。
5、药物管理:(1)研究者填写“专业处方”,并以此为凭证至临床试验药库领取试验药物。(2)领取的药物发放给受试者应填写《临床试验药物使用记录表》,并要求受试者签字。(3)应及时向受试者回收剩余药物。(4)回收的剩余药物,专业组药物管理员应及时返还至临床试验药库,并填写《临床试验药物返还记录表》。
6、人员管理:(1)获得“研究者授权书”的研究人员应定期参加GCP培训,每年培训时间不少于8小时的人员方能继续担任研究者,否则将中止其研究者资格。(2)研究人员(包括研究护士)每年至少更新一次《研究人员履历表》(见附件1),并提交至机构办公室存档备案。(3)首次申请研究者资格人员,应至少参加15学时的GCP培训后,填写《研究者申请表》(见附件2),向机构办提出申请,经审核附后要求后,授予《研究者授权书》方具有研究者资格。
7、AE与SAE:(1)处理:临床试验运行过程中发生AE与SAE,研究者应第一时间对受试者进行临床处理,保证受试者安全,必要情况下应联系主要研究者进行紧急揭盲,情况稳定后应进行随访直至受试者恢复正常。(2)报告:发生AE,研究者应在研究病历或病例报告表中记录,同时填写《药品不良反应/事件报告表》(见附件3)并交至机构质控员,以便上报与存档。发生SAE,研究者应在24h内报告机构办、伦理委员会、申办者、CRO与国家食品药品监督管理部门。(3)关系判断:研究者应对不良事件与研究药物的关系进行判断,可参照临床试验方案或《中药新药临床研究指导原则》中相关内容(见附件4)。
8、结束申请:(1)前提:完成所有病例的观察与记录;临床试验经费已结清;完成小结报告;获得伦理审查结束批件;临床试验药物已退还或销毁;临床试验资料已归档。(2)符合上述前提要求后,研究者向机构办公室提出结束申请,在收到《临床试验结束通知单》后,方能结束临床试验。
附件1:研究者履历表
附件2:研究者资格申请
附件3:药品不良反应事件报告表
附件4:不良事件与试验药物的关联性判断



 苏公网安备 32120202010258号
苏公网安备 32120202010258号